Этиленгликоль где применяется в холодильниках
Эволюция холода: хладагенты в современных холодильниках
Хладагент это рабочее вещество холодильной машины, которое при кипении и в процессе испарения отнимает тепло от охлаждаемого объекта, а затем после конденсации передаёт его окружающей среде.
Современные холодильники в основном компрессионные и, как следует из названия, имеют компрессор (а некоторые модели даже два). Кроме этого, конструкция предусматривает испаритель. Меж ними циркулирует хладагент. Сначала сжатый компрессором хладагент, находясь в газообразном состоянии, поступает в конденсатор длинную зигзагообразную трубку. Там он превращается в жидкость и отдаёт тепло окружающей среде. Через специальный регулирующий вентиль жидкий хладагент поступает в испаритель, который находится внутри теплоизолированной морозильной или холодильной камеры. Там давление падает, он начинает кипеть, испаряется, снова превращаясь в газ, отбирая при этом тепло у окружающего воздуха. Камера холодильника охлаждается. Испарившийся хладагент опять сжимается компрессором и попадает в конденсатор. И так цикл повторяется снова и снова. Этот принцип охлаждения используется в большинстве холодильников уже десятки лет.
1 компрессор; 2 нагнетательный трубопровод; 3 конденсатор; 4 фильтр-осушитель; 5 капиллярная трубка; 6 испаритель холодильной камеры; 7 испаритель морозильной камеры; 8 всасывающий трубопровод” src=”http://pics.rbc.ru/img/cnews/2008/02/15/1.jpg”>
Схема компрессионного холодильника:
1 компрессор; 2 нагнетательный трубопровод; 3 конденсатор; 4 фильтр-осушитель; 5 капиллярная трубка; 6 испаритель холодильной камеры; 7 испаритель морозильной камеры; 8 всасывающий трубопровод
Однако есть и другой тип холодильников, пусть и менее популярный сегодня, абсорбционные. Циркуляция рабочих веществ: абсорбента (воды) и хладагента (как правило, аммиака), имеющих разную температуру кипения при атмосферном давлении, осуществляется посредством абсорбции. Аммиак поглощается водой, получившаяся смесь подогревается с помощью электрического или газового нагревателя. При этом происходит выпаривание аммиака, который, испаряясь, потребляет теплоту камеры холодильника, то есть способствует её охлаждению. Абсорбционные холодильники в основном маленькие, однокамерные. Яркий пример такой техники великолукские холодильники «Морозко».

Схема устройства абсорбционного холодильника
Как всё начиналось
История появления холодильников, конечно, не сравнится с историей цивилизации, но всё-таки насчитывает несколько веков. В древности снег и лёд помогали людям сохранять пищу (этот способ длительного хранения продуктов питания пришёл в Европу из северных широт). У народов, населявших те края, замороженные рыба, оленина и ягоды хранились месяцами. Однако в более тёплом климате нужны были специальные ледяные шкафы, а поставлять лёд для них стоило очень дорого. Те, кто не мог себе это позволить, вынуждены были хранить продукты : квасить капусту, солить мясо, сушить фрукты и грибы. Так продолжалось довольно долго. Постепенно начали проводиться различные исследования, способствующие поиску решения вопроса сохранения пищи. Но прорыва удалось достигнуть только в 19 веке. В 1834 году появилась первая холодильная компрессионная машина. мир и столкнулся впервые с хладагентами. В этой машине использовался диэтиловый эфир.
Серийное производство холодильников в начале XX века активнее всего развивалось в США. Практически во всех машинах того времени в качестве хладагента использовались аммиак, различные эфиры и некоторые другие весьма токсичные и опасные для человека вещества. поломок таких агрегатов и контакта людей, в частности, с аммиаком высокой концентрации нередки были даже смертельные случаи. Поэтому учёные стали искать другие вещества, которые можно использовать в качестве хладагентов. Так появились фреоны.

Один из первых серийных американских холодильников Frigidaire
Воцарение фреонов
Фреоны это химические соединения на основе метана или этана. Их физическое состояние газы без цвета и запаха, безвредные для человека. Первой фреон синтезировала американская компания «Кинетик Кемикалз Инк» в начале годов прошлого века. Эта же фирма и дала название новому веществу. Тогда же было введено его обозначение: латинская буква «R» (по первой букве английского слова Refrigerant) и цифры: код, определяющий свойства. Первый фреон назывался (дифтордихлорметан). Фреон из чистого метана имеет марку , а из этана . Все остальные фреоны получаются смешением этих двух газов и замещением атомов водорода атомами хлора или фтора.
Сейчас в мире синтезировано более четырех десятков различных фреонов, отличающихся по свойствам и химическому составу. Основные требования, которые предъявляются к фреонам, это минусовая температура кипения при атмосферном давлении, конденсация при низком давлении, а также высокая хладопроизводительность. Кроме этого, необходимы высокий коэффициент теплопроводности и теплопередачи. Желательна и низкая стоимость. Таким требованиям лучше других раньше отвечали фреоны R-12 и R-11 (фтортрихлорметан), использовавшиеся обычно в бытовых холодильниках, а также R-22 (дифторхлорметан), применявшийся в низкотемпературных промышленных холодильных установках. Для получения очень низких температур были разработаны хладагенты , и .
Скрытая угроза
Всё шло прекрасно: и производители, и потребители были довольны. К 1976 году объём производства того же достиг почти 340 тысяч тонн. Определённая часть из этого количества предназначалась как раз для холодильных систем, систем охлаждения воздуха, баночек с аэрозолями Но годы прошлого века стали началом «тяжелых времён» для уже привычных фреонов. Ученые, исследовавшие причины нарушения озонового слоя Земли, пришли к выводу, что многие фреоны наносят ему ощутимый вред. Также оказалось, что фреоны участвуют в возникновении парникового эффекта, потому что задерживают инфракрасное излучение, которое испускает земная поверхность, а следовательно, способствуют глобальному потеплению.
Вообще, «экологическая опасность» фреонов зависит от содержания трех составляющих: хлора, фтора и водорода. Чем меньше атомов водорода, тем дольше фреон не разлагается и не наносит вред окружающей среде. А по мере увеличения числа атомов хлора растёт токсичность и озоноразрушающая способность фреонов. Вред, наносимый такими веществами озоновому слою, оценивается величиной озоноразрушающего потенциала. Чем он больше, тем вреднее фреон. Так, самый распространённый ранее имеет потенциал равный 1, 0,05, а наиболее вредными являются фреоны , , у которых озоноразрушающий потенциал достигает 13.
Чтобы защитить нашу планету от разрушительной деятельности человека, в 1987 году в соответствии со специальной программой ООН вступил в действие «Монреальский протокол по веществам, разрушающим озоновый слой», предусматривающий постепенное сокращение производства и потребления ряда вредных фреонов. Поэтому с тех пор в холодильниках не используют , . В 1992 году на конференции в Копенгагене было принято решение и о прекращении производства озоноопасных фреонов R11, R12 и R502 с 1 января 1996 года. Заменой им стали озонобезопасные хладагенты, такие, как , или (все три: гидрофторуглеродные соединения). Правда, безопасные агенты, например, R134а зачастую не отличаются прекрасными физическими и термодинамическими свойствами, и к тому же стоят довольно дорого, например, килограмм в 7 раз дороже такого же количества обычного . Также используются смеси, из нескольких хладагентов.

Озоновый слой планеты всё ещё под угрозой, хотя за 20 лет, прошедших с подписания монреальского протокола, есть ощутимые позитивные изменения. Фото сделано спутником NASA
Альтернатива фреонам
Однако и сегодня постоянно ведутся исследования, учёные пытаются синтезировать новые, максимально экологичные, более качественные по своим свойствам хладагенты. Разработкой альтернативных хладагентов озабочены многие государства, вкладывающие значительные финансовые средства в соответствующие исследования. По оценкам специалистов, за последние шесть лет на синтез новых хладагентов было потрачено свыше 2,4 миллиардов долларов.
Синтезированы хладагенты из пропана (R290), этилена (R1150), пропилена (R1270), изобутана (R600a). Производство холодильников, работающих на изобутане, освоили многие производители, причём не только в Европе или в Америке, но и на просторах бывшего СССР. Например, белорусская фирма Atlant предлагает покупателям модель за 15000 рублей, да и остальные свои модели этот производитель «перевёл» на безопасный изобутан.
Примеры моделей с хладагентом R600A:


Фирмой Du Pont был разработан ряд новых смесей хладогентов, известных под марками SUVA MP, SUVA МР39 (R401A), SUVA MP52 (R401C) и некоторые другие.
Увы, пока говорить о идеальном по своим характеристикам хладагенте рано. Сегодня главное то, что удалось разработать хладагенты безопасные для человека и окружающей среды. Именно они и используются в бытовых холодильниках и кондиционерах. Ну, а дальнейшее их совершенствование дело времени.
Где применяется Этиленгликоль – маслянистая жидкость, соединяемая с водой
Этиленгликоль – нашел свою область применения как химическое вещество имеющее низкую температуру замерзания. Это позволило его использовать в различных сферах деятельности .
В основном, эта масляная жидкость без запаха нашла себе применение в промышленной сфере для обработки техники. Самое большое достоинство этиленгликоля – это дешевизна его изготовления.
В настоящий момент, химическая промышленность выпускает множество средств на основе этиленгликоля для ухода за автомобилями.
Порядка шестидесяти процентов жидкости выпускаемой промышленностью сегодня идет на создание антифризов и тормозных жидкостей. А всё это происходит потому, что обыкновенная смесь глюколя и воды способна не замерзать при температуре внешнего воздуха 40 градусов Цельсия и ниже.
В состав охлаждающей жидкости, такой как тосол – этиленгликоль тоже входит.
А ещё гликоль может устранять коррозию металла. И поэтому его успешно добавляют в антикоррозийные химические составы для борьбы с коррозией.
Этиленгликоль может служить наполнителем в гидравлических системах.
В состав антистатиков тоже добавляют этиленгликоль.
Используется эта жидкость и как смазка в больших и малых холодильных установках.
Средства защиты против обледенения тоже выпускаются в основе своей на этиленгликоле.
Для антисептической обработки больших помещений этиленгликоль так же могут использовать.
В крем для обработки обуви, в небольших количествах, тоже добавляют этиленгликоль!
Это вещество вошло в обиход повсеместно.
Используют данное вещество как теплоноситель в батареях отопления на объектах и в домах.
Вещество имеет особенность поглощать в себя воду. Это используется для предотвращения обледенения топлива в авиации. А так же, вещество используется для предотвращения синтеза гидрата метана на трубопроводах пролегающих в море!
Целофан и полиуретан тоже производят при помощи этиленгликоля.
Производство большинства органических соединений на сегодняшний день не обходится без применения этиленгликоля.
При обращении с нерастворенным этиленгликолем необходимо соблюдать меры безопасности , так как это вещество может испаряться и слегка токсично.
Этиленгликоль относится к третьему классу опасности для химических веществ. Например, метан и бензин относятся к четвёртому классу опасности.
Самый безопасный – это пятый класс опасности.
А самый опасный – первый класс опасности для химических веществ и соединений . К первому классу относятся,например: ртуть , цинк, соли свинца. Ко второму: хлор, каустик, сероводород.
Вот такой пример применения химического вещества, с названием “этиленгликоль”.
Этиленгликоль – его свойства и сферы применения

Работа холодильных агрегатов требует использования не только хладагента, но и промежуточного хладоносителя. В качестве последнего часто применяется этиленгликоль, имеющий ряд преимуществ перед водными растворами солей, применяемыми для тех же целей. Но выгоден он только в том случае, если его физические свойства соответствуют требованиям установки по антикоррозийной устойчивости, сроку службу и металлоемкости.
Применение этиленгликоля
В чиллерах и холодильных агрегатах этиленгликоль применяется тогда, когда температура хладоносителя ниже 0°C . В таких системах теплопередача осуществляется по следующей схеме – охлаждаемая среда – этиленгликоль – хладагент. Реализация такого технического решения характеризуется более низкими рабочими температурами, чем без использования промежуточного хладоносителя. В этом случае достигается требуемый температурный перепад.
Этиленгликоль применяется в чиллере в составе раствора. Концентрация активного вещества может регулироваться. От нее зависит порог замерзания жидкости и, соответственно, рабочие характеристики всей установки. Низкозамерзающие характеристики этиленгликоля обусловили его широкое применение в системах промышленного холодоснабжения и кондиционирования. Как хладоноситель используется в виде рассола с несколькими показателями содержания. От пропорций этиленгликоля и воды напрямую зависит температура замерзания жидкости.
Раствор этиленгликоля применяется в системах, имеющих высокие требования к антикоррозийным свойствам и содержащих элементы из нержавеющей стали, например паяные пластинчатые испарители. Применение гликолевых рассолов в аммиачных машинах существенно снижает затраты на их содержание и расход энергии, продлевает срок службы, обеспечивает нормальные условия эксплуатации.
Общая характеристика этиленгликоля
Этиленгликоль представляет собой маслянистую бесцветную жидкость без запаха. В чистом виде без примесей закипает при температуре +197°C, а кристаллизируется при -12,3°C.
Наиболее часто применяют рассол с содержанием этиленгликоля 50-65%. В качестве добавок, определяющих свойства хладоносителя используются ингибиторы (антикоррозионные присадки, снижающие агрессивность к металлам, резине и другим материалам), стабилизаторы, антивспенивающие и моющие добавки. От концентрации рассола зависят также показатели теплоемкости, вязкости, воздействия на металлы и прочие материалы.
Помимо явных преимуществ – низкотемпературных характеристик, поддержания нужных характеристик и поддержания режима эксплуатации, у растворов этиленгликоля есть и недостатки. Активное вещество отличается токсичностью и наркотическим воздействием, негативно воздействует на работу нервной и мочевыводящей системы, поэтому работа с ними требует строго соблюдения правил безопасности при эксплуатации холодильной установки.
Отравление этиленгликолем
 Один из типичных представителей спиртов — это этиленгликоль. Эта жидкость входит в состав многих химических средств в том числе для ухода за машинами и помещениями. Но так как этиленгликоль имеет непосредственное отношение к спиртам — его периодически пытаются выпить как заменитель алкоголя. Не все знают, что именно этот представитель обладает наиболее выраженными отравляющими качествами.
Один из типичных представителей спиртов — это этиленгликоль. Эта жидкость входит в состав многих химических средств в том числе для ухода за машинами и помещениями. Но так как этиленгликоль имеет непосредственное отношение к спиртам — его периодически пытаются выпить как заменитель алкоголя. Не все знают, что именно этот представитель обладает наиболее выраженными отравляющими качествами.
Что такое этиленгликоль, какая у него формула и физические свойства? Как его получают и где применяют? Чем опасен для организма человека этот спирт? В каких случаях происходит отравление им и что за симптомы беспокоят при этом? Как нужно действовать, чтобы помочь пострадавшему?
Что такое этиленгликоль
Этиленгликоль — это представитель спиртов с двумя метильными группами в своём составе. Но в отличие от других он имеет немного маслянистую консистенцию.
Несмотря на то что этиленгликоль был получен ещё в 1859 году, он не сразу занял свою нишу в химии и промышленности. Изначально он использовался во времена Первой мировой войны, как замена глицерина, который широко применялся при производстве взрывчатых веществ.
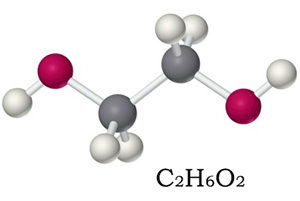
Химическая формула этиленгликоля — C2H6O2, рациональная — С2Н4(ОН)2. По своим физическим свойствам — это жидкость без запаха, но со сладким вкусом. Он легко соединяется с водой в любой консистенции, что успешно применяется в промышленности, ведь температура замерзания таких жидкостей очень низкая — это улучшает свойства «незамерзаек».
 У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
У этиленгликоля есть несколько названий, которые нередко можно встретить в составе продуктов химического производства:
- гликоль;
- этандиол-1,2;
- 1,2-диоксиэтан.
Чаще других употребляется основное название.
К какому классу опасности относится этиленгликоль? — к умеренно токсичное легковоспламеняющееся вещество.
Способы получения
Производством этиленгликоля в промышленных масштабах занялись ещё в тридцатые годы прошлого века. Одним из способов его получения тогда было окисление этилена до его оксида. Около 20 лет такой метод оставался единственным.
Немного позже этиленгликоль стали получать с помощью насыщения оксида этилена водой, в присутствии серной и ортофосфорной кислот. Этот способ оказался выгодней предыдущего, так как на выходе производили более 90% этиленгликоля с минимальным количеством примесей.
Где применяется
В основном этиленгликоль используют в промышленности для обработки техники, что обусловлено его стоимостью — это недорогой и всем доступный продукт.
 Он выпускается в химической промышленности для ухода за автомобилями:
Он выпускается в химической промышленности для ухода за автомобилями:
- более 50% вещества идёт на создание тормозных жидкостей и антифризов, так как смесь гликоля и воды способна сохранять жидкую консистенцию даже при 40º C ниже нуля;
- этиленгликоль входит в состав охлаждающей жидкости — тосола;
- он может устранять коррозию, поэтому гликоль добавляют в антикоррозийные химические соединения.
Где ещё используется этиленгликоль?
- Его можно обнаружить в составе антистатиков.
- Используют для производства средств защиты против обледенения.
- Служит смазкой в холодильных установках.
- Находит применение этиленгликоль как наполнитель в гидравлических системах.
- Гликоль нередко используют для дезинфекции больших помещений.
- Одно из ключевых применений вещества — это производство бытовых химических продуктов, к числу которых относится целлофан, полиуретан.
- Он используется не только при охлаждении автомобилей, но и компьютеров.
- Этиленгликоль или химические соединения в составе с ним применяется, как средство для чистки автомобильных стёкол и зеркал.
 В небольшом количестве присутствует в креме для обработки обуви.
В небольшом количестве присутствует в креме для обработки обуви.- Применяется этиленгликоль и в медицине, как составная часть криопротекторов для тканей и органов. То есть веществ, которые используют для заморозки.
- Это один из компонентов конденсаторов.
- Ключевым свойством этиленгликоля является поглощение воды, что успешно используется, чтобы предотвратить обледенение топлива в авиации и синтеза гидрата метана в трубопроводах, которые проходят в море.
- В органической химии его применяют как высокотемпературный растворитель.
- Без него не проходит синтез химических соединений.
- Где ещё используется этиленгликоль? — даже в наше время с его участием создают взрывчатые вещества.
За прошедшие десятилетия для этого двухатомного спирта нашлось множество применений, что, конечно же, обусловлено его свойствами. Но в медицине он известен не только как полезный и нужный продукт в быту, но и как средство, после контакта с которым человек может умереть.
Так что это такое этиленгликоль? — полезное химическое вещество, без которого не обходится производство большинства органических соединений или сильнодействующий яд с мощным отравляющим эффектом? Давайте узнаем, как может повлиять этиленгликоль на человека.
Влияние этиленгликоля на организм человека
Этот двухатомный спирт в основном входит в состав продуктов для ухода за помещениями, машинами и техникой. По своим физическим свойствам он отличается от привычного спирта маслянистой консистенцией и отсутствием запаха, поэтому его сложно перепутать с этанолом или изопропанолом, которые нередко употребляют внутрь. Возможны ли отравления этиленгликолем у людей? — да, несмотря на явные различия с другими спиртами отравиться им можно.
В каких случаях происходит отравление?
 Этиленгликоль является одним из средств обработки больших помещений. Во время нанесения моющих средств его пары вдыхаются, а при нарушении техники безопасности небольшое количество соединения может попасть в рот. Хотя для отравления этого недостаточно.
Этиленгликоль является одним из средств обработки больших помещений. Во время нанесения моющих средств его пары вдыхаются, а при нарушении техники безопасности небольшое количество соединения может попасть в рот. Хотя для отравления этого недостаточно.- Гликоль попадает внутрь при постоянной работе с ним, к примеру, если человек трудится на химическом производстве продуктов, содержащих этиленгликоль.
- Отравиться можно при случайном употреблении его внутрь.
- Так как это химическое соединение используется для обработки машин, то в группе риска находятся люди, регулярно сталкивающиеся с ним по долгу службы.
Этиленгликоль токсичен и относится к веществам третьего класса опасности. После поступления в организм человека он очень быстро всасывается в желудке и верхнем отделе тонкого кишечника. Не более 30% его выделяется в неизменном состоянии почками или в виде солей. Остальная же часть поступает в печень, где и происходит его преобразование.
В печени он разлагается до конечных продуктов:
- гликолевой кислоты;
- муравьиной и щавелевой кислоты;
- гликолевого альдегида.

Как влияет этиленгликоль на организм человека? Все эти конечные продукты распада действуют на кислотно-щелочное равновесие, что постепенно приводит к некрозу клеток головного мозга и почечной ткани. В организме развивается ацидоз или увеличение кислотности. Смертельная доза для человека составляет всего 100–150 мл. Но даже попадание небольшого количества этиленгликоля приведёт к развитию отравления, хотя и в лёгкой степени.
Симптомы отравления
В воспалительный процесс после употребления этиленгликоля вовлекаются не только почки и головной мозг. Спирт и его конечные продукты влияют на все системы органов. Скрытый период отравления этиленгликолем в среднем равен 12 часов, но он может укорачиваться или удлиняться в зависимости от количества употреблённого спирта.
 Какие симптомы отравления?
Какие симптомы отравления?
- Первый период (начальный) проявляется всего несколько часов, не более 12, и характеризуется лёгким опьянением. Человека беспокоит незначительная слабость и невнятная речь, но в целом самочувствие нормальное. В это время на отравление этиленгликолем указывает только необычный сладковатый запах, исходящий от человека. В редких случаях беспокоит тошнота, периодическая рвота, боли в животе.
- Спустя 12 часов после периода мнимого благополучия, возникает головокружение, головные боли, жажда и тошнота.
- К симптомам отравления этиленгликолем в это время относятся рвота, сильнейшие боли в желудке, которые напоминают признаки острого живота, боль в пояснице и мышцах.
- Немного позже на первое место выходят признаки поражения нервной системы: возбуждение и потеря сознания, появляются многочисленные судороги, увеличивается температура тела.
- Отравление этиленгликолем проявляется ещё и нарушением работы сердца и сосудов: увеличивается частота биения, снижается артериальное давление.
- Нарушается работа дыхательной системы: постепенно появляется одышка, поверхностное дыхание и отёк лёгких.
 Тяжёлые больные теряют сознание.
Тяжёлые больные теряют сознание.- Приблизительно на пятые сутки развивается нарушение в работе почек и печени. Из-за почечной недостаточности летальный исход наблюдается в течение одной недели.
- Смерть наступает в первые дни острого отравления из-за паралича дыхательного центра, отёка лёгких и вследствие сердечно-сосудистой недостаточности.
Лёгкое отравление этиленгликолем наблюдается чаще при вдыхании его паров небольшой концентрации. Оно проявляется незначительными симптомами: слабостью, подташниванием, головокружением.
Первая помощь при отравлении
К сожалению, часто причиной запоздалой или несвоевременной помощи становится лёгкое течение отравления, хроническая интоксикация парами этого спирта или позднее обращение пострадавшего человека к медработникам. В этом случае продукты распада гликоля уже оказывают своё повреждающее действие на внутренние органы и наносят непоправимый ущерб здоровью.

Что можно сделать на доврачебном этапе, чтобы помочь пострадавшему? Для этого необходимо быть уверенным в употреблении именно этого вещества. Если этиленгликоль был выпит недавно — нужно незамедлительно промыть желудок и ввести слабительное. Активированный уголь не окажет выраженного эффекта.
Быстро помочь при отравлении этиленгликолем, может, антидот — этанол. В этом случае применяется во внутрь его 30%-й раствор или 5%-й вводится внутривенно. А также в качестве антидота используется кальция хлорид или глюконат 10%-й раствор внутривенно или внутрь.
Не у всех под рукой могут оказаться нужные лекарства для оказания экстренных мероприятий. В этом случае неотложная помощь при отравлении этиленгликолем заключается во введении через зонд или рот обычной водки.
Если человек без сознания — его нужно уложить набок и дать доступ кислорода — открыть окно, развязать галстук и освободить от стягивающей одежды.
До момента начала активных действий нужно вызвать бригаду скорой помощи, так как пострадавшему понадобится госпитализация.
При отравлении этиленгликолем у детей нужно действовать незамедлительно и как можно скорее доставить пострадавшего малыша в ближайшую больницу!
Лечение отравления в стационаре
После госпитализации больному человеку проводят курс интенсивной терапии. Если пострадавшему не был дан антидот бригадой скорой помощи, то по прибытии в стационар его вводят сразу же.
Дальше лечение заключается в применении симптоматических препаратов для коррекции работы жизненно важных органов и систем.
 При отравлении этиленгликолем пострадавшему обеспечивают физический покой, доступ кислорода.
При отравлении этиленгликолем пострадавшему обеспечивают физический покой, доступ кислорода.- Назначают витамины группы B и C, АТФ (аденозинтрифосфорная кислота).
- При необходимости вводят преднизолон.
- При отравлении этиленгликолем назначают в большом количестве фолиевую кислоту, чтобы связать продукты распада этого двухатомного спирта.
- Вводят солевые растворы.
Профилактика отравления
Какая должна быть профилактика отравления этиленгликолем?
 При работе с химическими веществами, содержащими этиленгликоль, нужно использовать индивидуальные средства защиты.
При работе с химическими веществами, содержащими этиленгликоль, нужно использовать индивидуальные средства защиты.- Не стоит пить подозрительные жидкости.
- Хранить в недоступном для детей месте все химикаты для защиты и обработки машины, а также уборки помещений.
Этиленгликоль — насколько опасно это соединение? Нельзя недооценивать его негативное влияние на организм человека. Симптомы отравления, при попадании спирта внутрь, развиваются практически молниеносно, а смерть может наступить, спустя всего 5 дней. Отравление этиленгликолем очень легко предупредить и вылечить, если известно, что человек выпил. В противном случае терапия затягивается надолго.
Этиленгликоль – «незамерзающий» яд!
Этиленгликоль – «незамерзающий» яд!
Понятие и свойства
Этиленгликоль (МЭГ, моноэтиленгликоль) – химический реактив, который 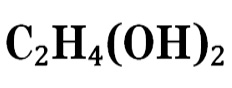 является представителем группы многоатомных спиртов, имеет вид сиропообразной жидкости с резким запахом и слегка сладковатым привкусом. Вещество хорошо растворяется в кетонах, воде, ацетоне, спирте, скипидаре, умеренно – в диэтиловом эфире, толуоле и бензоле. В нем плохо растворимы растительные масла и животные жиры, абсолютно не растворим парафин, каучук, минеральные масла. При взаимодействии с водой выделяется теплота, при этом объем этиленгликоля уменьшается.
является представителем группы многоатомных спиртов, имеет вид сиропообразной жидкости с резким запахом и слегка сладковатым привкусом. Вещество хорошо растворяется в кетонах, воде, ацетоне, спирте, скипидаре, умеренно – в диэтиловом эфире, толуоле и бензоле. В нем плохо растворимы растительные масла и животные жиры, абсолютно не растворим парафин, каучук, минеральные масла. При взаимодействии с водой выделяется теплота, при этом объем этиленгликоля уменьшается.
Этиленгликоль обладает способностью не замерзать даже при особо низких температурных  показателях, при этом снижать температуру замерзания веществ, в состав которых он входит. Поэтому с его помощью можно получить растворы, замерзание которых не происходит даже при -70 °С.
показателях, при этом снижать температуру замерзания веществ, в состав которых он входит. Поэтому с его помощью можно получить растворы, замерзание которых не происходит даже при -70 °С.
К списку свойств этиленгликоля можно отнести и свойства гликолей. Так, с такими химреактивами, как органические кислоты, образует сложные эфиры, щелочи и щелочные металлы – гликоляты. При окислении этиленгликоля возможно образование смесей гликолевого альдегида и щавелевой кислоты купить которую по доступной цене предлагает наш интернет магазин, а при окислении молекулярным кислородом – смесь муравьиной кислоты.
Данное химическое соединение выпускается двух марок: антифризный и волоконный, к последнему предъявляют очень серьезные требования к количественному содержанию примесей альдегидов.
Открытие этиленгликоля
Данный химический реактив впервые был получен химиком Вюрцом во Франции в середине XIX века. До начала Первой мировой войны он не имел широкого применения, позже в Германии во время военных действий его стали использовать как заменитель глицерина в процессе производства взрывчатых веществ. К 1930 году этиленгликоль стал активно использоваться многими известными производителями динамита.
Этиленгликоль – яд!
Токсические и ядовитые действия этиленгликоля зависят от ряда факторов, среди которых следует выделить:
– количество;
– индивидуальную чувствительность организма;
– состояние нервной системы;
– степень наполнения желудка и другие.
Дозы, которые могут привести в организме к необратимым изменениям и вызвать смертельное отравление этиленгликолем, могут варьироваться от 100 до 700 мл. По данным ряда исследований для человека летальной дозой является 50-200 мл. При поражении этиленгликолем смертность очень высока и составляет примерно 60 % всех случаев отравления.
Применение
Области применения данного химического реактива весьма разнообразны.  Благодаря своей низкой стоимости этиленгликоль, прежде всего, применяется в таких отраслях промышленности:
Благодаря своей низкой стоимости этиленгликоль, прежде всего, применяется в таких отраслях промышленности:
– в машиностроительной (в производстве тосола, тормозных жидкостях, антифриза);
– в текстильной (как растворитель красящих веществ);
– энергетической (как теплоноситель в отопительных системах);
– в химической (при производстве полимеров: целлофана, полиуретана, при синтезе высокотемпературных растворителей, для предотвращения процесса образования гидрата метана);
– электротехнической (в качестве вещества, защищающее объекты от замораживания, при производстве конденсаторов, как составляющий компонент в системе жидкостного охлаждения компьютеров);
– в военной (как исходное сырьё при производстве нитрогликоля – взрывоопасного вещества).
Меры безопасности, хранение
Хранить этиленгликоль необходимо в лабораторной посуде из стали, стойкой к коррозии, в закрытых неотапливаемых помещениях.
В связи с тем, что этиленгликоль ядовит, важно не допускать его попадания внутрь организма, так как это токсичное вещество влечет за собой необратимые изменения в работе внутренних органов и может привести к летальному исходу.
Этиленгликоль в соответствии с классификацией химвеществ причислен к третьему классу опасности: он взрывоопасен и горюч, поэтому при работе с ним следует придерживаться особых мер безопасности, используя защитные средства для органов дыхания – противогазы, респираторы, маски; для органов зрения – защитные очки; для кожных покровов – перчатки нитроловые, фартук, бахилы и другие резинотехнические изделия. Лабораторное оборудование и приборы должны быть использованы согласно требованиям инструкции по безопасности при работе с ядовитыми веществами.
Необходимо знать, что в случае отравления МЭГ первая доврачебная помощь должна быть проведена в срочном порядке. Это, прежде всего, промывание желудка плюс слабительные, вызывание рвоты, врачебная – назначение антидота.
Качественные химические реактивы по доступной цене
К выбору приобретения химических реактивов, а также любого другого лабораторного оборудования в Москве следует отнестись с особой ответственностью, так как от качества данной продукции зависят и результаты исследовательских процессов. Как кальций хлористый купить или молочную кислоту купить, так и этиленгликоль стоит в специализированных магазинах, где соблюдаются требования по хранению и отпуску товаров. Одним из таких является магазин химических реактивов Москва розница и оптовая торговля Prime Chemicals Group. Мы специализируемся только по продаже только сертифицированного лабораторного оборудования и химвеществ.
«ПраймКемикалсГрупп» – надежный помощник в оснащении Вашей лаборатории!
Этиленгликоль – двухатомный спирт для высококачественных антифризов
Этиленгликоль (1,2-этандиол, 1,2-диоксиэтан, гликоль) является базовым веществом для изготовления различных антифризов, которые используются в системах охлаждения двигателей транспортных средств.
Этиленгликоль – токсичный двухатомный спирт
Химическая формула данного простейшего многоатомного спирта – С2Н6О2 (иначе ее можно записать следующим образом – НО–СН2–СН2–ОН). Этиленгликоль имеет слегка сладковатый вкус, не имеет запаха, в очищенном состоянии выглядит, как немного маслянистая бесцветная прозрачная жидкость.
Так как он причислен к токсичным соединениям (по общепринятой классификации – третий класс опасности), следует избегать попадания данного вещества (в растворах и в чистом виде) в организм человека. Основные химические и физические свойства 1,2-диоксиэтана:
- молярная масса – 62,068 г/моль;
- коэффициент оптического преломления – 1,4318;
- температура воспламенения – 124 градуса (верхний предел) и 112 градусов (нижний предел);
- температура самовоспламенения – 380 °С;
- температура замерзания (стопроцентный гликоль) – 22 °С;
- температура кипения – 197,3 °С;
- плотность – 11,113 г/кубический сантиметр.

Пары описываемого двухатомного спирта вспыхивают в тот момент, когда его температура достигает 120 градусов. Еще раз напомним, что 1,2-этандиол имеет 3-й класс опасности. А это означает, что его предельно допустимые концентрации в атмосфере могут быть не более 5 миллиграмм/кубический метр. Если же этиленгликоль попадает в организм человека, в нем могут развиться необратимые негативные явления, которые способны привести к смерти. При однократном употреблении вовнутрь 100 и более миллилитров гликоля наступает летальный исход.

Пары данного соединения менее токсичны. Так как этиленгликоль характеризуется сравнительно малым показателем летучести, реальная опасность для человека возникает тогда, когда он систематически вдыхает пары 1,2-этандиола. О том, что есть вероятность отравления парами (либо туманами) рассматриваемого соединения, сигнализирует кашель и раздражение слизистой оболочки. Если человек отравляется гликолем, ему следует принять препарат, содержащий 4-метилпиразол (мощный антидот, подавляющий фермент алкогольдегидрогеназы), или этанол (одноатомный этиловый спирт).
Применение гликоля в разных областях техники
Малая себестоимость данного многоатомного спирта, его особые химические и физические свойства (плотность и другие) привели к тому, что он используется весьма широко в различных технических сферах.
Любой автомобилист знает, что представляет собой обычная охлаждающая жидкость для его «железного коня» под названием антифриз – этиленгликоля 60 % + воды 40 %. Такая смесь характеризуется температурой замерзания -45 градусов, очень трудно найти более подходящую жидкость для автомобильных систем охлаждения, несмотря даже и на высокий класс опасности 1,2-этандиола.

В автомобильной отрасли этиленгликоль находит применение и в качестве отличного теплоносителя. Кроме того, он используется в следующих сферах:
- органический синтез: химические свойства гликоля позволяют с его помощью защищать изофорон и другие карбонильные группы, использовать спирт в виде эффективного растворителя, работающего при повышенных температурах, а также в качестве основной составляющей специальной авиационной жидкости, уменьшающей явление обводнения горючих смесей для летательных аппаратов;
- растворение красящих соединений;
- изготовление нитрогликоля – мощного взрывчатого вещества на основе описываемого нами соединения;
- газодобывающая промышленность: гликоль не позволяет формироваться гидрату метана на трубах, кроме того, он поглощает излишнюю влагу на трубопроводах.

Нашел этиленгликоль применение и в качестве эффективного криопротектора. Его используют для производства кремов для обуви, в качестве важного элемента жидкостей для охлаждения компьютерной техники, при изготовлении 1,4-диоксина и разных видов конденсаторов.
Некоторые нюансы производства гликоля
В конце 1850-х годов химик из Франции Вюрц получил этиленгликоль из его диацетата, а чуть позже путем гидратации этиленоксида. Но в то время практического применения новое вещество нигде не нашло. Лишь в 1910-х годах его начали использовать при изготовлении взрывчатых соединений. Плотность гликоля, его иные физические свойства и дешевизна производства обусловили то, что им заменили глицерин, который применялся до этого.

Особые свойства 1,2-этандиола по достоинству оценили американцы. Именно они наладили в середине 1920-х его промышленное изготовление на специально построенном и оборудованном заводе в Западной Вирджинии. В последующие годы гликоль использовали почти все известные на то время компании, занимавшиеся производством динамита. В настоящее время интересующее нас соединение, которое имеет третий класс опасности, изготавливается по технологии гидратации окиси этилена. Существует два варианта его производства:
- с участием ортофосфорной либо серной кислоты (до 0,5 процентов) при температуре от 50 до 100 °С и давлении в одну атмосферу;
- при температуре около 200 °С и давлении в десять атмосфер.

В результате реакции гидратации образуется до 90 процентов чистого 1,2-диоксиэтана, некоторое количество полимергомологов и триэтиленгликоля. Второе соединение добавляют в гидравлические и тормозные жидкости, оно применяется в промышленных системах охлаждения воздуха, из него делают препараты для дезинфекции, а также пластификаторы.
Важнейшие требования ГОСТ 19710 к готовому гликолю
С 1984 года действует ГОСТ 19710, который устанавливает требования к тому, какие свойства (температура замерзания, плотность и так далее) должен иметь этиленгликоль, используемый на предприятиях автомобилестроения и в других отраслях народного хозяйства, где на его основе выпускают разнообразные составы.
По ГОСТ 19710 гликоль (как жидкость) может быть двух типов: первого сорта и высшего сорта. Доля (массовая) воды в гликоле первого сорта должна быть до 0,5 %, высшего – до 0,1 %, железа – до 0,00005 и 0,00001 %, кислот (в пересчете на уксусную кислоту) – до 0,005 и 0,0006 %. Остаток после прокаливания готового продукта не может быть более 0,002 и 0,001 %.

Цвет 1,2-диоксиэтана по ГОСТ 19710 (по шкале Хазена):
- после кипячения в растворе кислоты (соляной) – 20 единиц для продукции высшего сорта (первый сорт не нормируется по цвету);
- в стандартном состоянии – 5 (высший сорт) и 20 единиц (первый сорт).
В Государственном стандарте 19710 выдвигаются специальные требования к процессу производства описываемого простейшего спирта:
- используется исключительно герметичная аппаратура и оборудование;
- производственное помещение обязательно оснащается вентиляцией, рекомендованной для работы с соединениями, которым присвоен третий класс опасности;
- при попадании гликоля на оборудование или землю его следует сразу же обильно смывать водной струей;
- персонал, работающий в цеху по производству 1,2-этандиола, обеспечивается противогазом модели «БКФ» либо иным приспособлением для защиты органов дыхания, соответствующим ГОСТ 12.4.034;
- возгорания гликоля тушат при помощи инертных газов, специальных пенных составов, а также тонкораспыленной воды.

Готовая продукция по ГОСТ 19710 проверяется различными методами. Например, массовая часть двухатомного спирта и диэтиленгликоля устанавливается способом изотермической газовой хроматографии по технологии так называемого «внутреннего эталона». При этом используются весы для лабораторных исследований (ГОСТ 24104), стеклянная или стальная газохроматографическая колонка и хроматограф с детектором ионизационного типа, измерительная линейка, микрошприц, лупа оптическая (ГОСТ 25706), выпарительная чашка и другой инструмент.
Цвет гликоля устанавливают по стандарту 29131 при помощи секундомера, специального цилиндра, конической колбы, соляной кислоты, холодильного агрегата. Массовая часть железа устанавливается по Госстандарту 10555 по методике сульфациловой фотометрии, остатка после прокаливания – по Госстандарту 27184 (посредством выпаривания полученного соединения в платиновой либо кварцевой емкости). А вот массовая часть воды определяется электрометрическим или визуальным титрованием с использованием реактива Фишера в бюретках емкостью 10 либо 3 кубических сантиметра.
Антифриз – охлаждающая жидкость на основе гликоля
Антифриз на основе простейшего многотомного спирта применяется в современных транспортных средствах с целью охлаждения их двигателя. Его основным компонентом является этиленгликоль (есть составы с пропиленгликолем в качестве основного компонента). Добавками служит дистиллированная вода и специальные присадки, которые придают антифризу флуоресцентные, антикавитационные, антикоррозионные, антипенные свойства.
Главная характеристика антифризов – малая температура замерзания. Кроме того, они имеют низкий показатель расширения при замерзании (по сравнению с обычной водой на 1,5–3 процента меньше). При этом такая специальная охлаждающая жидкость на основе гликоля характеризуется высокой температурой кипения, что улучшает процесс эксплуатации транспортного средства в жаркую пору года.

В целом жидкость для охлаждения автодвигателей на основе гликоля и воды обладает следующими достоинствами:
- отсутствие вредных добавок (аминов, разнообразных нитритов, неблагоприятно влияющих на природу фосфатов);
- возможность выбора необходимой концентрации антифриза для качественного предохранения двигателя автомобиля от замерзания;
- стабильные параметры и свойства в течение всего срока службы;
- совместимость с теми деталями охлаждающей системы авто, которые сделаны из пластмассы или резины;
- высокие антипенные показатели.

Кроме всего прочего, современные антифризы обеспечивают антикоррозионную защиту металлических сплавов и металлов, имеющихся в двигателе внутреннего сгорания за счет наличия в них особых ингибирующих добавок.


 В небольшом количестве присутствует в креме для обработки обуви.
В небольшом количестве присутствует в креме для обработки обуви. Этиленгликоль является одним из средств обработки больших помещений. Во время нанесения моющих средств его пары вдыхаются, а при нарушении техники безопасности небольшое количество соединения может попасть в рот. Хотя для отравления этого недостаточно.
Этиленгликоль является одним из средств обработки больших помещений. Во время нанесения моющих средств его пары вдыхаются, а при нарушении техники безопасности небольшое количество соединения может попасть в рот. Хотя для отравления этого недостаточно. Тяжёлые больные теряют сознание.
Тяжёлые больные теряют сознание. При отравлении этиленгликолем пострадавшему обеспечивают физический покой, доступ кислорода.
При отравлении этиленгликолем пострадавшему обеспечивают физический покой, доступ кислорода. При работе с химическими веществами, содержащими этиленгликоль, нужно использовать индивидуальные средства защиты.
При работе с химическими веществами, содержащими этиленгликоль, нужно использовать индивидуальные средства защиты.
